
ผศ. ดร. มัณฑนา บัวหนอง
คณะทรัพยากรชีวภาพและเทคโนโลยี มหาวิทยาลัยเทคโนโลยีพระจอมเกล้าธนุรี
แวนด้าพันธุ์สันทรายบลู (V. crimson Glory x V. coerulea) มีการผลิตเอทิลีนในปริมาณน้อยมาก ประมาณ 0.3 µL kg-1FW h-1 ในระหว่างวันที่ 3-11 ของการปักแจกัน แต่มีความไวต่อเอทิลีนสูง เนื่องจากการให้เอทิลีนจากภายนอกที่ความเข้มข้น 1-10 ppm นาน 24 ชั่วโมง ทำให้ดอกกล้วยไม้มีการตอบสนองต่อเอทิลีนอย่างชัดเจน คือ เกิดอาการซีดจางของสีกลีบดอกและเปลี่ยนจากสีม่วงเป็นสีขาว (Color bleaching) ปริมาณแอนโทไซยานินในกลีบดอกลดลงเกิดอาการดอกฟุบ (Sleepiness) เนื่องมาจากสูญเสียน้ำ และมีอายุการปักแจกันสั้นลง 50% อาการเหล่านี้มีผลต่อคุณภาพของดอกและสามารถใช้เป็นตัวกำหนดการสิ้นสุดอายุการปักแจกันดอก (Khunmuang et al., 2019a, b) มีรายงานว่า น้ำตาลมีผลกับการสังเคราะห์เอทิลีนและการส่งสัญญาณในดอกไม้ที่มีความไวต่อเอทิลีน (Pun and Ichimura, 2003; van Doorn, 2004; Hoebericht et al., 2007; Yuan et al., 2012) ในดอกคาร์เนชั่น น้ำตาลสามารถยับยั้งเอทิลีนโดยไปลดปริมาณ 1-Aminocyclopropane-1-carboxylic-acid (ACC) และกิจกรรมของเอนไซม์ Acetyl-CoA synthetase (ACS) และ 1-Aminocyclopropane-1-carboxylic acid oxidase (ACO) จึงชะลอการเสื่อมสภาพของดอกได้ (Verlinden and Garcia, 2004) น้ำตาลยังเป็นตัวเพิ่มประสิทธิภาพในการสังเคราะห์แอนโทไซยานินและการพัฒนาอวัยวะสืบพันธุ์ (Reproductive organ) เช่น ดอกไม้ ดังนั้น การเพิ่มความเข้มข้น และปฏิกิริยา Phosphorylation ของน้ำตาลโดยเอนไซม์ Hexokinase จึงมีบทบาทสำคัญในการพัฒนาสีกลีบดอก (Weiss, 2000) การให้น้ำตาลจากภายนอกยังสามารถกระตุ้นระดับการแสดงออกของยีนที่เกี่ยวข้องกับการสังเคราะห์แอนโทไซยานินในดอกไม้ได้ เช่น น้ำตาลชักนำให้มีการแสดงออกของยีน Chalcone synthase (CHS) ที่ได้จากกลีบดอกพิทูเนียในใบ Arabidopsis ตัดต่อพันธุกรรม (Tsukaya et al., 1991)
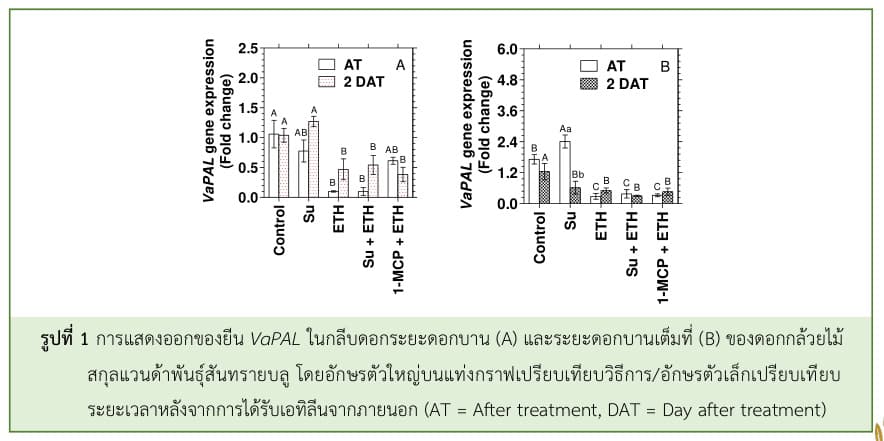
จากการศึกษา พบว่า การให้น้ำตาลแก่ดอกกล้วยไม้แล้วรมด้วยเอทิลีนไม่ได้ช่วยลดความรุนแรงของการตอบสนองต่อเอทิลีนและการเปลี่ยนสีของกลีบดอก แต่การให้น้ำตาลซูโครส แล้วรมด้วย 1-MCP ก่อนได้รับเอทิลีนจากภายนอกกระตุ้นให้ดอกกล้วยไม้มีปริมาณแอนโทไซยานินเพิ่มสูงขึ้นเมื่อเปรียบเทียบกับชุดควบคุม แต่เอทิลีนจากภายนอกส่งผลให้ปริมาณแอนโทไซยานินในดอกกล้วยไม้ลดลงประมาณ 1.5-2 เท่า เมื่อเปรียบเทียบกับชุดควบคุม (ไม่แสดงรูป) เมื่อวิเคราะห์การแสดงออกยีนที่เกี่ยวข้องกับการสังเคราะห์แอนโทไซยานิน พบว่า ระดับการแสดงออกยีน VaPAL ในดอกกล้วยไม้สกุลแวนด้าพันธุ์สันทรายบลู ในระยะดอกบานสูงกว่าในระยะดอกแย้ม การปักแช่ดอกกล้วยไม้ในน้ำตาลซูโครสสามารถชักนำให้มีระดับการแสดงออกของยีน VaPAL ในระยะดอกแย้มสูงกว่าชุดควบคุม และมีการแสดงออกยีน VaPAL ในระยะดอกบานเพิ่มขึ้นในวันที่ 2 หลังทรีทเม้นต์ (2 DAT) (รูปที่ 1) โดย PAL เป็นเอนไซม์ตัวแรกและเป็น Rate-limiting enzyme ในวิถีการสังเคราะห์แอนโทไซยานิน อีกทั้ง PAL ยังช่วยต้านทานต่อความเครียด และช่วยให้การทำงานต่าง ๆ ภายในโครงสร้างต้นพืชทำงานได้อย่างเป็นปกติ ระดับการแสดงออกของยีน PAL นั้นสัมพันธ์กับการสะสมแอนโทไซยานินส่วนต่าง ๆ PAL มีการแสดงออกมากขึ้นในพืชตระกูล Malus และ Allium cepa ในระยะบริบูรณ์ (Liang et al., 2014; Sun et al., 2012) ผลการศึกษานี้ยังสอดคล้องกับรายงานของ Vitrac et al. (2000) ที่พบว่า การเพาะเลี้ยงเซลล์แขวนลอย Vitis vinifera ในซูโครสสามารถชักนำให้มีการสังเคราะห์แอนโทไซยานินเพิ่มขึ้น ในแรดิชสีขาวพันธุ์ ‘Incicle’ ยีนที่ตอบสนองต่อน้ำตาลซูโครสมีเพียงยีน PAL และ CHS ส่วนยีน CHI, F3H, DFR และ ANS ถูกยับยั้งหรือถูกกด จึงทำให้มีการสะสมแอนโทไซยานินน้อย (Hara et al., 2004) อย่างไรก็ตามเอทิลีนจากภายนอกกระตุ้นให้ระดับการแสดงออกของยีน VaPAL ลดลงอย่างรวดเร็วทั้งในระยะดอกแย้มและดอกบาน ถึงแม้ว่าระดับการแสดงออกยีน VaPAL จะเพิ่มขึ้นในวันที่ 2 หลังทรีทเม้นต์ (2 DAT) การให้น้ำตาลแก่ดอกกล้วยไม้แล้วรมด้วยเอทิลีนไม่ได้ช่วยชะลอการลดลงของระดับการแสดงออกของยีน VaPAL ในขณะที่ 1-MCP ช่วยชะลอการลดลงของยีน VaPAL ในระยะดอกบานเท่านั้น
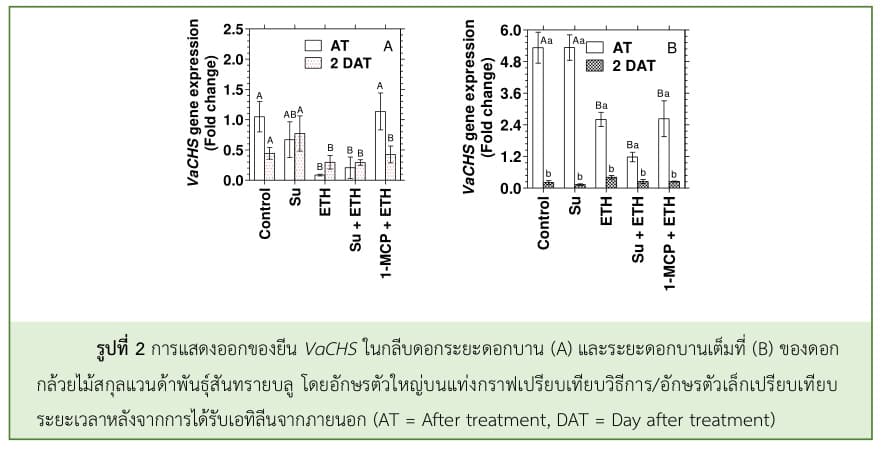
สำหรับยีน VaCHS มีการแสดงออกในดอกกล้วยไม้สกุลแวนด้าพันธุ์สันทรายบลูระยะดอกบานสูงกว่าระยะดอกแย้มประมาณ 5-7 เท่า โดยน้ำตาลซูโครสและ 1-MCP มีรูปแบบการแสดงออกของยีน VaCHS ที่คล้ายคลึงกับชุดควบคุมในดอกกล้วยไม้ทั้ง 2 ระยะการบาน แต่ระดับการแสดงออกของยีนVaCHS ในระยะดอกบานลดลงอย่างรวดเร็วในวันที่ 2 หลังทรีทเม้นต์ (2 DAT) ในชุดควบคุม ดอกกล้วยไม้ที่ได้รับน้ำตาลซูโครสเพียงอย่างเดียว และดอกกล้วยไม้ที่รม 1-MCP และได้รับเอทิลีนจากภายนอก (รูปที่ 2) โดยทั่วไป การสังเคราะห์แอนโทไซยานินที่ถูกชักนำโดยน้ำตาลซูโครสจะเกิดขึ้นผ่านยีน CHS และ ANS ใน Hypocotyl ของแรดิชสีแดงพันธุ์ ‘Comet’ พบว่า อัตราส่วนการแสดงออกของยีน CHS:ANS สูงเป็น 3 เท่า ภายใน 6 วันหลังจากปลูก (Hara et al., 2004) อย่างไรก็ตาม เอทิลีนจากภายนอกชักนำให้ยีน VaCHS ในระยะดอกแย้มและระยะดอกบานลดลงทันทีหลังจากทรีทเม้นต์ (AT) และการให้น้ำตาลแก่ดอกกล้วยไม้แล้วรมด้วยเอทิลีนมีรูปแบบการแสดงออกของยีน VaCHS ลดลงเช่นเดียวกับการดอกกล้วยไม้ที่ได้รับเอทิลีนเพียงอย่างเดียว
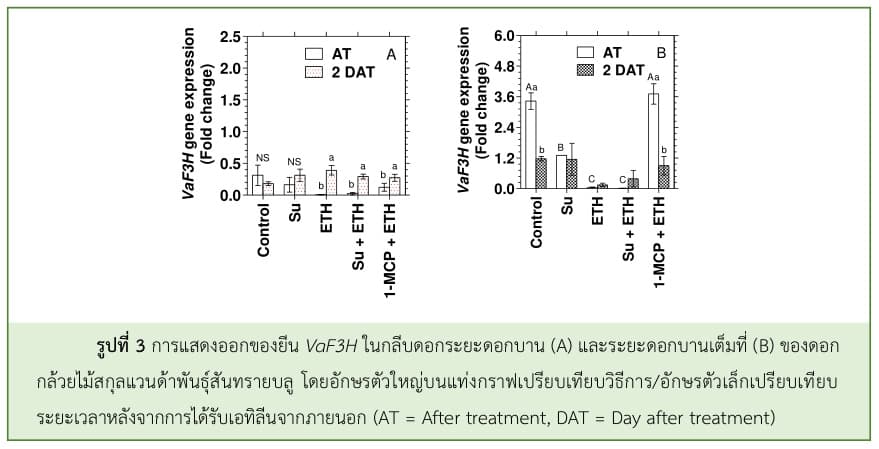
F3H ถอดรหัสเป็นเอนไซม์ที่เร่งปฏิกิริยา Hydroxylation ของ Flavonone ที่ตำแหน่ง C3 ให้เปลี่ยนเป็น Dihydroflavonol โดย F3H นี้ยังเป็นเอนไซม์หลักที่จุดแตกแขนง (Branch point) ของวิถีการสังเคราะห์ฟลาโวนอยด์ สามารถทำงานได้อย่างอิสระ แต่บางครั้ง F3H ก็ทำงานร่วมกับเอนไซม์ CHS และ CHI ที่อยู่ต้นวิถีเพื่อสังเคราะห์ผลิตภัณฑ์ที่อยู่ถัดลงมา (Downstream product) (Owens et al., 2008) จากการศึกษา พบว่า ยีน VaF3H มีระดับการแสดงออกต่ำกว่ายีน VaCHS และมีการแสดงออกในระยะดอกบานสูงกว่าในระยะดอกแย้ม และการให้น้ำตาลแก่ดอกกล้วยไม้สกุลแวนด้าพันธุ์สันทรายบลูไม่มีผลต่อระดับการแสดงออกของยีน VaF3H ในระยะดอกแย้ม แต่กลับมีการแสดงออกที่ลดลงประมาณ 3 เท่าในระยะดอกบานเมื่อเปรียบเทียบกับชุดควบคุม โดยชุดควบคุมและ 1-MCP มีระดับการแสดงออกของยีน VaF3H ในระยะดอกบานใกล้เคียงกัน เอทิลีนจากภายนอกชักนำให้ระดับการแสดงออกของยีน VaF3H ลดลงอย่างรวดเร็วประมาณ 30-60 เท่า ในดอกกล้วยไม้ทั้ง 2 ระยะ ถึงแม้ว่าระดับการแสดงออกของยีน VaF3H จะเพิ่มขึ้นในวันที่ 2 หลังทรีทเมนต์ และยังพบว่า การให้น้ำตาลแก่ดอกกล้วยไม้แล้วรมด้วยเอทิลีนมีรูปแบบการแสดงออกของยีน VaF3H ลดลงเช่นเดียวกับการดอกกล้วยไม้ที่ได้รับเอทิลีนเพียงอย่างเดียว (รูปที่ 3) แสดงให้เห็นว่า น้ำตาลไม่ได้ช่วยชะลอการลดลงของยีน VaF3H ในดอกกล้วยไม้ที่ถูกชักนำโดยเอทิลีนจากภายนอก
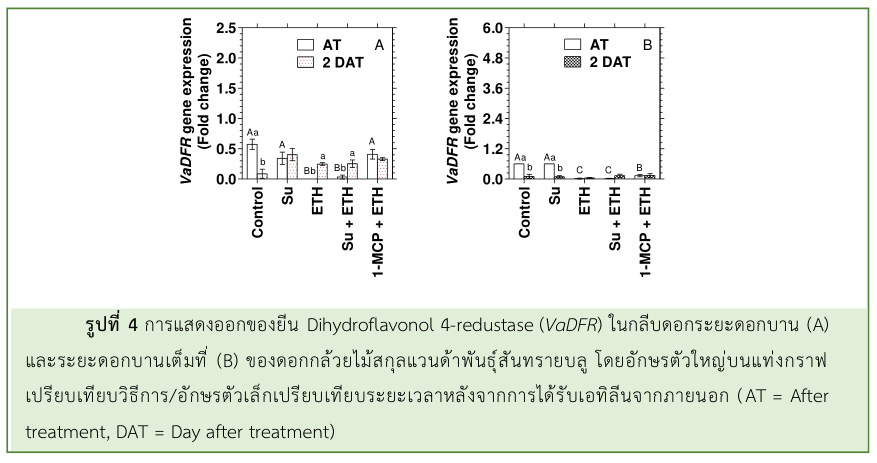
ซึ่งมีรูปแบบการแสดงออกของยีน VaDFR คล้ายคลึงกับดอกกล้วยไม้ที่ได้รับเอทิลีนเพียงอย่างเดียว (รูปที่ 4) แสดงให้เห็นว่า น้ำตาลไม่ได้ช่วยชะลอการลดลงของยีน VaDFR ในดอกกล้วยไม้ที่ถูกชักนำโดยเอทิลีนจากภายนอก ใน Arabidopsis ที่ปลูกในสภาพที่มีแสง การลดลงของแอนโทไซยานินที่ถูกชักนำโดยเอทิลีนจะถูกควบคุมที่ระดับ ทรานสคริปชัน โดยปริมาณแอนโทไซยานินจะสัมพันธ์กับระดับการแสดงออกของยีนโครงสร้าง เช่น DFR, LDOX และ UF3GT ซึ่งอยู่ภายใต้การควบคุมยีนควบคุม เช่น bHLH TFs (GL3 และ TT8), R2R3-MYB, PAP1 และ R3-MYB, MYBL2 (Dare et al., 2008) ดังนั้น อาการฟอกขาวของสีกลีบดอกกล้วยไม้สกุลแวนด้าพันธุ์สันทรายบลูหลังจากได้รับเอทิลีนจากภายนอก มีความสัมพันธ์กับปริมาณแอนโทไซยานินที่ลดลง และระดับการแสดงออกของยีน VaF3H ลดลงอย่างรวดเร็วประมาณ 3.5 เท่า ในระยะดอกแย้ม และ 2.0 เท่า ในระยะดอกบาน อีกทั้ง ยีน VaDFR ที่ไม่พบการแสดงออกเลย หลังจากได้รับเอทิลีน แสดงให้เห็นว่า VaF3H และ VaDFR อาจจะเป็นยีนหลักในการควบคุม สีดอกกล้วยไม้สกุลแวนด้าพันธุ์สันทรายบลู อย่างไรก็ตาม Khunmuang et al. (2019b) รายงานว่า เอทิลีนจากภายนอกที่ชักนำให้ปริมาณแอนโทไซยานินในกลีบดอกกล้วยไม้สกุลแวนด้าพันธุ์สันทรายบลูลดลงอย่างรวดเร็ว อาจจะเป็นผลมาจากการสลายตัวของแอนโทไซยานินมากกว่าการยับยั้งการสังเคราะห์แอนโทไซยานิน และการสลายตัวของ แอนโทไซยานินส่งผลต่อการเปลี่ยนแปลงสีกลีบดอก (Bleaching) ซึ่งเกิดขึ้นก่อนอาการเสื่อมสภาพต่าง ๆ ในดอกไม้ ในการศึกษานี้ แสดงให้เห็นว่า เอทิลีนจากภายนอกที่ชักนำให้ปริมาณแอนโทไซยานินในกลีบดอกลดลงอย่างรวดเร็วนั้นน่าจะเกี่ยวข้องกับทั้ง 2 กระบวนการ คือ การสลายตัวของแอนโทไซยานิน และการยับยั้งการสังเคราะห์แอนโทไซยานินในระดับทรานสคริปชันด้วย การใช้ 1-MCP ก่อนได้รับเอทิลีนจากภายนอก สามารถช่วยชะลอการเปลี่ยนสีกลีบดอกในกล้วยไม้สกุลแวนด้าพันธุ์สันทรายบลู ได้ Khunmuang et al. (2019a, b) รายงานว่า 1-MCP สามารถยืดอายุการปักแจกันของกล้วยไม้ได้ประมาณ 1-2.5 วัน โดยยืดอายุการปักแจกันของกล้วยไม้สกุลแวนด้าพันธุ์ ‘Pure wax’ ได้ร้อยละ 20 และพันธุ์ ‘Pachara Delight’ และ ‘Sansai Blue’ ได้ร้อยละ 10 เนื่องจาก 1-MCP เป็นสารยับยั้งการทำงานของเอทิลีน ทำหน้าที่แย่งจับกับตัวรับเอทิลีน (Ethylene receptor) แบบไม่ผันกลับ ทำให้ เอทิลีนไม่สามารถเข้าจับกับตัวรับเอทิลีนได้ จึงไม่เกิดการโอนถ่ายสัญญาณและตอบสนองต่อเอทิลีน (Seglie et al., 2011; Daneshi Nergi and Ah-madi, 2014)
บทความนี้ตีพิมพ์ลงใน Postharvest Newsletter ปีที่ 22 ฉบับที่ 1 มกราคม – มีนาคม 2566
เอกสารอ้างอิง
- Daneshi Nergi, M.A. and Ahmadi, N. 2014. Effects of 1-MCP and ethylene on postharvest quality and expression of senescence-associated genes in cut rose cv. Sparkle. Scientia Horticulturae 166 : 78-83.
- Dare, A.P., R.J. Schaffer, K. Lin-Wang, A.C. Allan and R.P. Hellens. 2008. Identification of a cis-regulatory element by transient analysis of co-ordinately regulated genes. Plant Methods 4 : 17.
- Hara, M., K. Oki, K. Hoshino and T. Kuboi. 2004. Effects of sucrose on anthocyanin production in hypocotyl of two radish (Raphanus sativus) varieties. Plant Biotechnology Journal 21: 401-405.
- Hoeberichts, F.A., W.G. van Doorn, O. Vorst, R.D. Hall and M.F. van Wordragen. 2007. Sucrose prevents up-regulation of senescence-associated genes in carnation petals. Journal of Experimental Botany 58 : 2873-2885.
- Khunmuang, S., S. Kanlayanarat, C. Wongs-Aree, S. Meir, S. Philosoph-Hadas and M. Buanong. 2019a. Variability in the response to ethylene of three cultivars of cut Vanda orchid flowers. Acta Horticulturae 1262: 241-249.
- Khunmuang, S., S. Kanlayanarat, C. Wongs-Aree, S. Meir, S. Philosoph-Hadas, M. Oren-Shamir, R. Ovadia and M. Buanong. 2019b. Ethylene induces a rapid degradation of petal anthocyanins in cut Vanda ‘Sansai Blue’ orchid flowers. Frontiers in Plant Science 10: 1-13.
- Liang, Y., X.Y. Liu, H.W. Zhang and W. Tan. 2014. Cloning and expression analysis of an anthocyanin bio-synthesis-related gene (AcPAL1) in onion (Allium cepa L.). Journal of Agriculture Biotechnology 222: 47-54.
- Owens, D.K., K.C. Crosby, J. Runac, B.A. Howard and B.S. Winkel. 2008. Biochemical and genetic characterizat ion of Arabidopsis flavanone 3beta-hydroxylase. Plant Physiology and Biochemistry 46 : 833-843.
- Pun, U.K. and K, Ichimura. 2003. Role of sugars in senescence and biosynthesis of ethylene in cut flowers. The Japan Agricultural Research Quarterly 37 : 219-224.
- Petit, P., T. Granier, B.L. d’Estaintot, C. Manigand, K. Bathany, J.M. Schmitter, V. Lauvergeat, S. Hamdi and B. Gallois. 2007. Crystal structure of grape dihydroflavonol 4-reductase a key enzyme in flavonoid biosynthesis. Journal of Molecular Biology 368: 1345-1357.
- Seglie, L., K. Martina, M. Devecchi, C. Roggero, F. Trotta. and V. Scariot. 2011. The effect of 1-MCP in cyclodextrin-based nanospronges to improve the vase life of Dianthus caryophyllus cut flowers. Postharvest Biology and Technology 59(2): 200-205.
- Sun, B.L., Q.U. Bai-Hong and L.I. Wei. 2012. Cloning and expression analysis of gene fragments of related fruit-coloring enzymes in Pingguoli. Journal of Jilin Agricultural University 34: 423-427.
- Tsukaya, H., T. Ohshima, S. Naito, M. Chino and Y. Komeda. 1991. Sugar-dependent expression of the CHS-A gene for chalcone synthase from petunia in transgenic Arabidopsis. Plant Physiology 97: 1414-1421.
- van Doorn, W.G. 2004. Is petal senescence due to sugar starvation? Plant Physiology 134: 35-42.
- Verlinden, S. and J.J.V. Garcia. 2004. Sucrose loading decreases ethylene responsiveness in carnation (Dianthus caryophyllus cv. White Sim) petals. Postharvest Biology and Technology 31 : 305-312.
- Vitrac, X., F. Larronde, S. Krisa, A. Decendit, G. Deffieux and J.M. Merillon. 2000. Sugar sensing and Ca+2-calmodulin requirement in Vitis vinifera cells producing anthocyanins. Phytochemistry 53: 659-665.
- Weiss, D. 2000. Regulation of flower pigmentation and growth: multiple signalling pathways control anthocyanin synthesis in expanding petals. Physiologia Plantarum 110 : 152-157.
- Yuan, Y., H.M. Qian, Y. Wang, Y.M. Shi and D.Q. Tang. 2012. Hormonal regulation of Freesia cut flowers and FhACS1. Scientia Horticulturae 143: 75-81.



