โดย ..ผศ.ดร.เฉลิมชัย วงษ์อารี
GMOs หรือ Genetically Modified Organisms คือ สิ่งมีชีวิตที่ได้จากการดัดแปลงสารพันธุกรรม (DNA) ซึ่งมนุษย์ใช้วิธีทางพันธุวิศวกรรมสร้างขึ้นมา สิ่งมีชีวิตที่ว่านี้อาจเป็น จุลินทรีย์ พืช หรือ สัตว์ ซึ่งอาหารที่ได้จาก GMOs ส่วนใหญ่ที่ได้รับการกล่าวถึงในปัจจุบัน คือ จุลินทรีย์และพืช ทั้งนี้วิธีการดัดแปลงและเปลี่ยนถ่ายสารพันธุกรรมโดยมากใช้ Recombinant DNA Technology ซึ่งบังคับให้ยีนเป้าหมายไปรวมตัวกับ DNA เจ้าบ้านและกระตุ้นให้มีการแสดงออก โดยนิยมนำมาใช้ในทางการแพทย์และการเกษตร
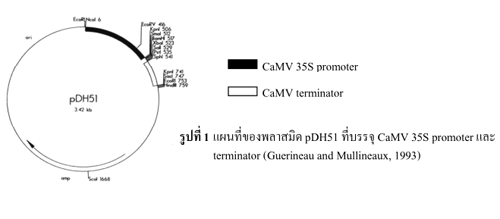
ตัวควบคุมการแสดงออกของยีน (promoter) หลายชนิดได้มาจากจุลินทรีย์ เช่น CaMV 35S promoter ที่มีการแสดงออกตลอดเวลาในเซลล์พืชเกือบทุกชนิด (รูปที่ 1) วิธีการดัดแปลงและเปลี่ยนถ่ายสารพันธุกรรมคือ การโคลนยีนเป้าหมายแล้วนำมาใส่ระหว่าง promoter และ terminator ที่ต้องการ รวมไปถึงเลือกยีนที่ใช้ในการคัดเลือก (marker gene) ซึ่งส่วนใหญ่เป็นยีนที่สามารถต้านทานยาปฏิชีวนะ สำหรับวิธีการนำยีนให้เข้าไปแสดงออกในพืชและสิ่งมีชีวิตอื่น ๆ นิยมใช้ 2 วิธี คือใช้วิธียิงยีนเข้าไปโดยตรง (Gene Bombartment) และการใช้ Agrobacterium spp. โดยใน รูปที่ 2 แสดงถึงขั้นตอนการทำโครงสร้างของยีน (gene construction) ภายในการขับเคลื่อนของ CaMV 35S promoter จากนั้นนำ gene construction ที่ได้มาใส่ระหว่าง right border (RB) และ left border (LB) ของ Transfer plasmid (T-plasmid) ที่มี gene construction ของ ani-kanamycin gene อยู่ด้วย แล้วนำไปใส่ใน Agobacterium เพื่อให้ส่งผ่านชิ้น DNA ที่อยู่ระหว่าง RB และ LB เข้าไปรวมเข้า (แบบสุ่ม) กับโครโมโซมของพืชเป้าหมาย
ตัวอย่างอาหารพืช GM ที่มีการผลิตและกระจายไปทั่วโลก เช่น มะเขือเทศ มะละกอ และแคนตาลูปซึ่งสามารถการชะลอการสุก ฝ้าย BT ซึ่งผลิตโปรตีนจากเชื้อจุลินทรีย์ที่มีคุณสมบัติในการฆ่าหนอนเจาะสมอฝ้ายได้ ถั่วเหลืองที่ทนต่อยากำจัดวัชพืชและให้ผลผลิตสูง ข้าวโพดที่ทนแมลงและยากำจัดวัชพืช มะละกอต้านทานเชื้อ papaya ring spot virus มันฝรั่ง และ Canola ซึ่งทนต่อยากำจัดวัชพืช แมลง และไวรัส
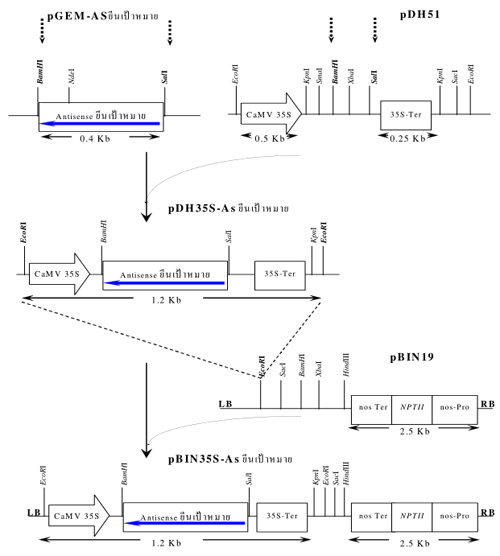
รูปที่ 2 ตัวอย่างขั้นตอนการทำ gene construction ของ Antisense (AS) ยีนเป้าหมาย ในพลาสมิด pBIN 19 ที่ความคุมการแสดงออกโดย CaMV 35S promoter และ terminator (pGEM:พลาสมิดเพื่อการโคลนนิ่ง, pDH51:พลาสมิดที่บรรจุ CaMV 35S promoter และ terminator, pBIN 19 เป็น T-plasmid ของ Agobacterium โดยมี NPTII: anyikanamycin gene และ right border (RB) และ left border (LB) )
เนื่องจากขั้นตอนการทำ GMOs มีความเสี่ยงต่อความปลอดภัยทางชีวภาพในหลาย ๆ ด้าน และตัว GMOs เองก็ยังบรรจุยีนหรือ DNA แปลกปลอมเข้าไป ซึ่งบางส่วนอาจจะมาจากจุลินทรีย์หรือเป็นยีนที่ต้านทานยาปฏิชีวนะที่ใช้ในขั้นตอนการคัดเลือก นอกจากนี้ขั้นตอนการนำชิ้น DNA เข้าสู่โครโมโซมพืชเป้าหมายยังเป็นแบบสุ่ม ไม่สามารถกำหนดตำแหน่งได้แน่นอน ซึ่งอาจจะไปมีผลต่อเมทาบอลิซึมเดิมอื่น ๆ อันอาจทำให้พืชมีการผลิตโปรตีนที่ผิดปกติไป ดังนั้นในปัจจุบันนักวิทยาศาสตร์มีวิธีการตรวจหา GMOs ในพืชหรืออาหาร โดยเน้นไปที่ 2 เป้าหมายคือ ชิ้น DNA ที่ใส่เข้าไป และโปรตีนที่อาจสร้างขึ้นมาใหม่โดย GMOs นั้น โดยวิธี polymerase chain reaction (PCR) ใช้ในการประเมินในส่วนของ DNA และ enzyme-linked immunosorbent assays (ELISA) ใช้วิเคราะห์ในเชิงโปรตีน นอกจากนี้ยังมีเทคนิคใหม่ๆ เช่น microarrays, mass spectrometry, bio-sensor และ surface plasmon resonance ที่กำลังมีการพัฒนาอยู่ (Miraglia et al., 2004; Michelini et al., 2008; van Dijk et al., 2010)
ผลของการแปรรูปอาหารต่อการทำลาย DNA พืช
วิธีการแปรรูปอาหารแบบต่าง ๆ ทำให้มีการทำลาย DNA ของพืช รวมไปถึงชิ้นส่วนของยีนที่ใส่เข้าไปในพืช GMOs ด้วย โดยขั้นตอนการแปรรูปอาจมีผลต่อการเสื่อมสภาพของ DNA พืชได้ดังนี้ (Gryson, 2010)
- อุณหภูมิสูง (High temperature): อุณหภูมิสูงในระหว่างการแปรรูปทำให้ DNA มีการคลายเกลียวและแยกเป็นสายเดี่ยว (denaturation) โดยกลไกที่ทำลาย DNA คือสภาพการเกิด depurination และ/หรือ deamination อย่างไรก็ตามอุณหภูมิสำหรับการทำอาหารกระป๋องหรือการนึ่งความดันที่ 121°C นาน 15 นาที ก็ไม่สามารถทำลาย DNA ได้ทั้งหมด
- การทำให้แห้ง (Drying): อุณหภูมิการอบแห้งยิ่งสูงยิ่งสามารถทำลาย DNA ได้ดี แต่อย่างไรก็ตามอาหารอบแห้งยังคงตรวจหาชิ้นส่วนของ DNA โดย PCR ได้ดี
- การปรุงอาหาร (Cooking): การใช้อุณหภูมิ 95°C กับอาหารที่มีความชื้นนาน 60 นาที จะทำลาย DNA ให้มีความยาวเฉลี่ยน้อยกว่า 600 bp หรือการใช้ไมโครเวฟที่ 800 W นาน 15 นาที จะทำให้ DNA ของพืชถูกทำลายอย่างมาก การใช้สารเคมีบางอย่างระหว่างการต้มอาจจะช่วยเร่งการทำลายชิ้น DNA โดยการใช้น้ำมะนาว 1% และต้มที่ 100°C นาน 20 นาที จะทำให้พืชมีขนาด DNA เล็กกว่า 600 bp
- การนึ่งความดัน (Autoclaving): การนึ่งความดันผลิตภัณฑ์ที่ 121°C นาน 15 นาที มีผลต่อการทำลาย DNA มากกว่าการปรุงอาหาร โดยทำให้ DNA เป็นชิ้นเล็กว่า 295 bp
- การอบ (Baking): การอบขนมปังที่อุณหภูมิ 200 – 230°C สามารถทำลาย DNA ได้อย่างดี โดยเฉพาะอย่างยิ่งการอบอาหารที่มีความชื้นมาก
- การย่าง (Roasting): การย่างมีความรุนแรงมากซึ่งสามารถตรงเข้าไปยังตรงใจกลางของชิ้นอาหารตัวอย่าง
- การทอด (Frying): DNA ของพืชถูกทำลายอย่างมากเมื่อถูกทอดที่ 150 -175°C นาน 1- 3 นาที โดยทำให้มีขนาดไม่ถึง 100 bp
- PH: ผักและผลไม้มีเป็นผลผลิตที่มี pH ต่ำ ซึ่งจัดเป็นกรดและสามารถทำลายโมเลกุลของพิวรีนใน DNA ได้ และการทำลายจะถูกเร่งเมื่อทำร่วมกับการให้ความร้อน อย่างไรก็ตามเมื่อใช้ pH สูงมักทำลายโครงสร้างของ DNA ได้น้อยกว่า เนื่องจาก DNA ค่อนข้างเสถียรในด่าง
- การหมัก (Fermentation): การหมักทำให้ส่วนของ transgenic DNA ในพืชค่อย ๆ ลดลงจนกระทั่งวันที่ 120 ของการหมักก็จะไม่สามารถตรวจสอบส่วนของ CaMV 35S promoter ของพืชตัวอย่างได้ โดยการทำลาย DNA ระหว่างขบวนการหมัก อาจเกิดจาก DNAses ที่มาจากเชื้อจุลินทรีย์
- Mechanical treatments: การบด การตัด การใช้คลื่นเสียง (sonication) และ การฉายรังสี (irradiation) ไม่เพียงแต่ทำลาย DNA ของพืชตัวอย่าง วิธีและขบวนการสกัดแบบต่าง ๆ ยังทำให้ DNA มีโมเลกุลที่เล็กลง
- Enzymatic degradation: การแตกหักเซลล์พืชจากขั้นตอนการเตรียมอาหารจะทำให้เอนไซม์ endonucleases ผ่านออกมาและเข้าไปทำลายชิ้น DNA
การประเมินความปลอดภัยของอาหาร GMOs
ใช้หลักการของความเท่าเทียมกันในสาระสำคัญ (Substantial Equivalence Concept: SEC) โดยเปรียบเทียบพืชอาหาร GMOs กับพืชอาหารปกติที่ผลิตจากวิตถุดิบธรรมชาติ (Novak and Haslberger, 2000)
- 1. ผลิตภัณฑ์อาหารที่แสดงว่ามีสาระสำคัญเท่ากันกับอาหารหรือส่วนประกอบของอาหารที่มีอยู่เดิม ข้อมูลที่ทำการประเมินประกอบด้วย 1. คำอธิบายชนิดของพืชดัดแปลงพันธุกรรม (recombinant-DNA plant) 2. คำอธิบายชนิดของพืชเป้าหมายที่ใช้ (host plant and its use as food) 3. คำอธิบายชนิดของสิ่งมีชีวิตต่าง ๆที่ใช้ในขั้นตอนการทำ (the donor organism(s)) 4. คำอธิบายชนิดและคุณลักษณะของการดัดแปลงพันธุกรรม (genetic modification(s)) 5. แสดงส่วนประกอบที่ไม่ใช่ DNA-RNA (non-nucleic acid substances) 6. แสดงส่วนประกอบสำคัญ 7. การประเมินการเปลี่ยนแปลงสาร metabolites 8. ขั้นตอนการแปรรูป 9. การดัดแปลงคุณค่าทางโภชนาการ 10. สิ่งอื่น ๆ ที่ควรพิจารณา
- 2. ผลิตภัณฑ์อาหารที่แสดงว่ามีสาระสำคัญเท่ากันกับอาหารหรือส่วนประกอบของอาหารที่มีอยู่เดิมเว้นแต่มีข้อแตกต่างที่แสดงให้เห็นชัดเจน
- 3. ผลิตภัณฑ์อาหารที่แสดงสาระสำคัญไม่เท่ากันกับอาหารหรือส่วนประกอบของอาหารที่มีอยู่เดิม
ในกรณีที่แสดงความไม่เท่าเทียมกันในสาระสำคัญ ก็ไม่ได้หมายความว่าผลิตภัณฑ์ไม่ปลอดภัย การทดสอบความปลอดภัยนั้นควรมีการออกแบบกรณี ๆ ไป ตามคุณลักษณะอ้างอิงของอาหารหรือส่วนประกอบของอาหารนั้น และควรมีการศึกษาปัญหาเกี่ยวกับอาการแพ้ที่เกิดขึ้นจากใช้เทคนิคการดัดแปลงสารพันธุกรรมในอาหารนั้นด้วย
แนวความคิดหลักในการควบคุมหรือบริหารจัดการ GMOs หรือ ผลิตภัณฑ์จาก GMOs ให้มีความปลอดภัย คือ ต้องมีความปลอดภัยทางชีวภาพ (biosafety) และความปลอดภัยของอาหาร (food safety)โดยอาจใช้หลักการในการควบคุม 2 ประเด็นคือ การประเมินความปลอดภัยก่อนออกสู่ท้องตลาด และกระบวนการผลิตต้องเป็นไปตามมาตรฐาน โดยการแสดงฉลากอาหารที่ได้จากการตัดแต่งสารพันธุกรรมและอาหารที่มีสารก่อให้เกิดการแพ้อาหาร
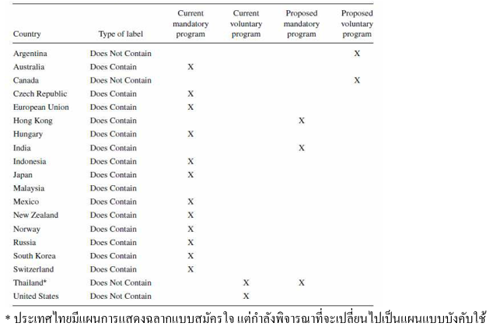
การแสดงฉลาก (Labelling) ของอาหาร GMOs (Crespi and Marette, 2003)
ฉลากมีวัตถุประสงค์ที่จะให้ข้อมูลแก่ผู้บริโภคที่ชัดเจนเป็นจริง และเป็นกลาง โดยอาศัยหลักการทางวิทยาศาสตร์ เพื่อให้ปฏิบัติตามได้อย่างง่าย การแสดงฉลากต้องมีความเหมาะสม มีกฎของการแสดงฉลากที่รัดกุม ประเทศส่วนใหญ่ทั่วโลกมีกฎหมายบังคับให้ติดฉลากบ่งบอกว่าเป็นอาหาร GMOs แต่ประเทศในแถบอเมริกาเหนือ-ใต้กำหนดให้บริษัทและผู้ประกอบการสามารถแสดงฉลากอาหารที่มีส่วนประกอบของ GMOs แบบสมัครใจ (ตารางที่ 1) โดยการควบคุมการแสดงฉลากในบางประเทศมีดังนี้
- Codex: หน่วยงานร่วมของ WHO/FAO คณะกรรมาธิการมาตรฐานอาหารระหว่างประเทศ (Codex Alimentation Commission) ได้จัดทำเป็นมาตรฐานนานาชาติที่มีการควบคุมและแสดงฉลากของอาหารที่ได้จากการเปลี่ยนแปลงยีนนั้น ซึ่งกำลังปรับปรุงระเบียบและวิธีการในการควบคุม (König, 2010)
- กลุ่มสหภาพยุโรป (อียู): การติดฉลากนี้บังคับเป็นกฎหมายของอียู ให้มีการแสดงฉลากของผลิตภัณฑ์ที่มี หรือประกอบด้วย หรือได้มาจาก GMOs ผลิตภัณฑ์ที่ปราศจาก GMOs สามารถวางตลาดโดยไม่ต้องระบุในฉลาก สำหรับผลิตภัณฑ์ที่ผ่านการรับรองว่าไม่มี GMOs ถ้าต้องการระบุในฉลากจะต้องเป็นไปตามข้อกฎของอียู สำหรับผลิตภัณฑ์ที่มี ให้แสดงฉลาก “ประกอบด้วยวัตถุที่เป็น GMOs ต้องพิสูจน์ด้วยวิธีการทางวิทยาศาสตร์ และต้องมีขั้นตอนการติดตามการสอบกลับได้ (Miraglia et al., 2004) และในกรณีที่ไม่สามารถแยกวัตถุดิบได้และไม่มีหลักฐานแสดง ให้มีการบังคับแสดงฉลาก “ผลิตภัณฑ์นี้ อาจประกอบด้วย…” นอกจากนี้ยังมีการตั้งระดับปริมาณ GMOs ที่อาจมีอยู่ในส่วนประกอบของอาหารโดยบังเอิญ โดยกำหนดเป็นขั้นต่ำไม่เกิน 1 % สำหรับส่วนประกอบของอาหาร ซึ่งเกณฑ์ขั้นต่ำ ที่เสนอนั้น ใช้ปฏิบัติเฉพาะสำหรับวัตถุที่เตรียมไว้สำหรับการบริโภคของคน
- สหรัฐอเมริกา: กำหนดให้แสดงฉลากอาหารแบบสมัครใจ โดยให้ระบุถึงการเปลี่ยนแปลงยีน (genetic modification) สารที่เป็นพิษ (toxicants)สารอาหาร (nutrients) และ สารชนิดใหม่ (new substance)
- ญี่ปุ่น: พืช GMOs ซึ่งมีสาระสำคัญ (SEC) ไม่เท่ากับอาหารที่มีอยู่เดิมตามธรรมชาติและอาหารสำเร็จรูป ที่ผ่านกรรมวิธีผลิต ต้องมีการแสดงฉลาก โดยอาหารที่มีปริมาณของ GMOs เป็นส่วนประกอบ จะต้องแสดงฉลากว่า GMO-used และอาหารที่ไม่มีปริมาณของ GMOs เป็นส่วนประกอบ จะต้องแสดงฉลากว่า GMO non-separated
ตารางที่ 1 การเปรียบเทียบกฎหมายของการติดฉลากที่บอกถึงอาหารที่มี/ไม่มีส่วนประกอบของ GMOs ในประเทศต่าง ๆ ทั่วโลก (Crespi and Marette, 2003)
นโยบายการประเมินความเสี่ยงของ GMOs ของประเทศต่าง ๆ (Paoletti et al., 2008)
- สหรัฐอเมริกา: จะแสดงฉลากต่อเมื่อผลิตภัณฑ์ประกอบด้วยสารภูมิแพ้ที่ทราบชนิดแล้ว และอยู่ในส่วนประกอบของอาหารที่ถูกเปลี่ยนแปลง
- แคนนาดา: เป็นประเทศที่ผลิตเมล็ดพืช GMOs มากเป็นอันดับสอง รองจากอเมริกา และกฎหมายการแสดงฉลากคล้ายๆกับสหรัฐอเมริกา
- เม็กซิโก: เป็นผู้นำการผลิตแป้งข้าวโพด ประกาศว่าจะหลีกเลี่ยงการนำเข้าข้าวโพดดัดแปลงยีน ซึ่งเป็นหนึ่งในไม่กี่ประเทศในทวีปอเมริกาประกาศการบังคับใช้การแสดงฉลากอาหาร GMOs
- ญี่ปุ่น: อาหารที่แสดงฉลาก แบ่งออกเป็น 3 ชนิด ตามแผน คือ อาหารที่เสริมคุณค่าของอาหาร โดยผลิตขึ้นจาก GMOs หรืออาหาร GMOs ที่มีปริมาณสารอาหารเพิ่มขึ้น (อาหารส่วนมากที่ต้องแสดงฉลาก จะจัดอยู่ในกลุ่มนี้) และอาหารที่ไม่ทราบส่วนผสมของวัตถุดิบจากธรรมชาติ และจาก GMOs ต้องแสดงฉลาก แจ้งให้ผู้บริโภคทราบว่า มีวัตถุดิบจาก GMOs อยู่ แต่ไม่ได้แสดงรายละเอียด
- เกาหลีใต้: พิจารณาหลีกเลี่ยงการซื้อเมล็ดข้าวโพด และถั่วเหลืองจากสหรัฐอเมริกาเพื่อหลีกเลี่ยงเมล็ดพืช GMOs และมีการใช้กฎหมายควบคุมคุณภาพการเกษตรและประมง เพื่อควบคุมการแสดงฉลาก GMOs
- ออสเตรเลีย/นิวซีแลนด์: มีมาตรฐานการบังคับใช้ฉลากอาหาร GMOs โดยขึ้นอยู่กับสารก่อภูมิแพ้ และการเปลี่ยนแปลงของคุณภาพสารอาหาร และส่วนประกอบของอาหาร
- สหภาพยุโรป (อียู): การบังคับใช้ฉลากสำหรับวัตถุดิบ GMOs ให้มีผลบังคับใช้ การควบคุมได้กำหนดเฉพาะว่า ภาชนะบรรจุใด ผลิตขึ้นสำหรับผลิตภัณฑ์ที่มี GMOs จะต้องมีอักษรแสดงอย่างชัดเจนว่า “ได้รับการเปลี่ยนแปลงยีน”
- สหราชอาณาจักร: มีการวางระเบียบควบคุมการใช้ GMOs ได้ก้าวหน้าที่สุดในกลุ่มอียู รัฐบาลอังกฤษบังคับใช้กฎหมายให้ภัตตาคาร และผู้จำหน่ายอาหารทุกแห่ง ต้องแสดงฉลากผลิตภัณฑ์อาหาร GMOs
ข้อดีของ GMOs
- เป็นการพิสูจน์ข้อสมมติฐานทางวิทยาศาสตร์ของการเปลี่ยนแปลงเมทาบอลิซึมในสิ่งมีชีวิต
- ทำให้เกิดสายพันธ์ใหม่จาก 2 สายพันธุ์ (หรือมากกว่า) ที่ไม่อาจสามารถผสมกันได้ทางธรรมชาติ
- สามารถเลือกปรับปรุงคุณสมบัติที่ต้องการได้โดยตรง
- ทำให้เกิดธัญพืช ผัก หรือผลไม้ที่มีคุณสมบัติเพิ่มขึ้นในทางโภชนาการ และมีคุณค่าในเชิงพาณิชย์
- มีประโยชน์อย่างกว้างขวางทางการแพทย์
- ควบคุมการผลิตได้ง่าย ให้ผลผลิตสูง ทนต่อสภาพแวดล้อม ลดการใช้สารเคมี
ข้อเสียของ GMOs
- อาจทำให้ความหลากหลายทางพันธุกรรมของสิ่งมีชีวิตตามธรรมชาติหมดไป
- ความกังวลต่อการถ่ายเทยีนออกสู่สิ่งแวดล้อม
- ความกังวลในเรื่องการเป็นพาหะของสารพิษ และต่อการเกิดสารภูมิแพ้
- อาจมีการผลิตสารบางชนิดที่เป็นสารก่อโรค หรือมีผลกระทบต่อสิ่งมีชีวิตที่มีประโยชน์ชนิดอื่น
- อาจทำให้เกิดการผูกขาดทางการตลาด โดยบริษัทชั้นนำของโลกเพียงไม่กี่บริษัท
- ยังไม่สามารถพิสูจน์ชัดถึงความปลอดภัย 100%
ทิศทางของ GMOs ในประเทศไทย
ด้วยความหวั่นวิตกเกี่ยวกับ GMOs ที่จะทำให้ความหลากหลายของหน่วยพันธุกรรมในธรรมชาติลดลง และยังรวมไปถึงการเกิดพันธุ์พืชแปลก ๆ โดยถ้ามีการรวมของยีนจาก GMOs เข้าไปในเซลล์ของสิ่งมีชีวิตชนิดอื่น ๆ จะสิ่งมีชีวิตนั้นมีความผิดปกติไปหรืออาจก่อให้เกิดความต้านทานต่อยาปฏิชีวนะ โดยถ้าเกิดความผิดพลาดในการเปลี่ยนถ่ายหน่วยพันธุกรรมแล้ว จะไม่สามารถถ่ายหรือล้างกลับได้ และจะคงอยู่และแพร่พันธุ์ต่อไปตลอดทุกชั่วอายุ ทำให้เกิดสิ่งมีชีวิตสายพันธุ์ใหม่ที่จะขยายและกระจายไปทั่วโลกโดยไม่สามารถควบคุมได้
ประเทศไทยเคยมีการทดลองและผลิตพืช GMOs มาแล้วในอดีตทั้งในระดับห้องปฏิบัติการวิจัย และนำมาปลูกทดสอบในแปลงปลูกภายนอกอาคาร โดยยังขาดกฎหมายที่ควบคุมรองรับอย่างรัดกุม ดังนั้นเมื่อการประท้วงอย่างรุนแรงจากคณะและองค์กรต่าง ๆ (http://www.greenpeace.or.th/) ทำให้รัฐบาล ณ ขณะนั้นได้ประกาศให้ประเทศไทยเป็นประเทศที่ปลอดจากปลูกพืช GMOs ยกเว้นแต่เพื่อใช้ในการศึกษาและวิจัยในห้องทดลองเท่านั้น โดยเล็งเห็นถึงประโยชน์จากการปลูกและการผลิตพืชอาหารด้วยวิธีการปกติดั้งเดิมที่จะเป็นจุดแข็งในตลาดอาหารของประเทศไทย จวบจนกระทั้งปัจจุบัน (พ.ศ. 2553) ก็ยังไม่อนุญาตให้ปลูกทดสอบพืช GMOs ในระดับแปลงทดลอง หากสถานการณ์ยังเป็นเช่นนี้การทำการศึกษาเรื่อง GMOs ของประเทศไทยคงยังพัฒนาอยู่ในระดับงานวิจัย ยังไม่สามารถแข่งขันกับประเทศที่พัฒนาแล้ว เช่น สหรัฐฯ ออสเตรเลีย ญี่ปุ่น แม้กระทั่งประเทศในกลุ่มอาเซียนด้วยกันอย่าง มาเลเซีย หรือสิงคโปร์ เกษตรกรหรือผู้ผลิตอาหารของไทยจะเป็นแต่ฝ่ายซื้อเทคโนโลยี และในปัจจุบันประเทศไทยคงไม่สามารถหลีกเลี่ยงให้อุตสาหกรรมอาหารปลอด GMOs ได้ ซึ่งหากนำเข้าอาหาร GMOs มาใช้ในประเทศไทยเพื่อแปรรูปเป็นอาหารสำเร็จรูปแล้วส่งออก จะต้องแสดงในฉลากบนอาหารนั้นด้วย ซึ่งจะมีอุปสรรคทางการค้าในอนาคตได้
การใช้ประโยชน์จาก GMOs มีมานานแล้ว โดยเฉพาะทางการแพทย์ที่มีการใช้เพื่อผลิตยาเพื่อมาใช้กับผู้ป่วย เป็นที่ยอมรับอย่างกว้างขวางแม้ในสหภาพยุโรปที่กฎข้อบังคับเรื่องการใช้ GMOs ที่เคร่งครัด (อ้างถึง EC. No. 726/2004 (HSE, 2007)) แต่เมื่อต้องนำมาให้มนุษย์หรือสัตว์บริโภคโดยตรงหรือทำเป็นผลิตภัณฑ์อาหารกลับได้รับแรงต่อต้านอย่างมาก อย่างไรก็ดีจากกระแสความต้องการอาหาร และความไม่แน่นอนสภาพภูมิอาการและขนาดพื้นที่ปลูก การศึกษาทดลองเรื่อง GMOs อาจจะต้องนำกลับมาพิจารณาอย่างจริงจังในทุกภาคส่วนของประเทศ ซึ่งหากยังไม่สามารถปฏิบัติหรือบังคับใช้กฎหมายได้อย่างจริงจังก็ยังไม่ควรอนุญาตให้มีการปลูกทดลอง ซึ่งอาจจะเป็นเหมือนในอดีตที่มีการเพาะปลูกปะปนกันระหว่างพืชที่มาจากวิธีทั่วไปและมาจาก GMOs ทำให้ไม่สามารถจะควบคุมกำกับได้ รัฐบาลจะต้องมีการให้ความรู้ ความเข้าใจอย่างถูกต้องอย่างต่อเนื่อง รวมไปถึงการออกกฎหมายและบังคับใช้อย่างจริงจัง โดยการผลิต GMOs จะต้องผ่านขั้นตอนที่ได้รับการรับรองว่าปลอดภัยต่อ คน สัตว์ และสภาพแวดล้อม โดยอาจยึดแนวทางของ European Food Safety Authority (EFSA: 2006; Varzakas et al., 2007; Smith and König, 2010) ซึ่งมีการทำงานเรื่องนี้มาอย่างต่อเนื่องและยาวนาน (Davison, 2010) หรือของ EPA จากประเทศสหรัฐอเมริกา (the U.S. Environmental Protection Agency (Sayre and Seidler, 2005) โดยต้องยึดหลักการประเมินความเสี่ยงของสิ่งมีชีวิตดัดแปลงพันธุกรรม (GM Risk Assessment: Sparrow, 2010) เป็นหลักในการปฏิบัติอย่างเคร่งครัด
เอกสารอ้างอิง
Crespi, J. M. and Marette, S. (2003). “Does Contain” vs. “Does Not Contain”: Does it matter which GMO label is used? European Journal of Law and Economics 16: 327–344.
Davison, J. (2010). GM plants: Science, politics and EC regulations. Plant Science 178: 94–98.
Gryson, N. (2010). Effect of food processing on plant DNA degradationvand PCR-based GMO analysis: a review. Anal Bioanalytical Chemistry 396: 2003–2022.
Guerineau, F. and Mullineaux, P. (1993). Plant transformation and expression. In Plant Molecular Biology: Lab Fax, (ed. R. R. D. Croy), pp. 121-147. Oxford: Bios Scientific Publishers.
HSE. (2007). The SACGM Compendium of guidance, Part 6: Guidance on the use of genetically modified microorganisms in a clinical setting. http://www.hse.gov.uk/biosafety/gmo/acgm/acgmcomp.
König, A. (2010). Compatibility of the SAFE FOODS Risk Analysis Framework with the legal and institutional settings of the EU and the WTO. Food Control 21: 1638–1652.
Michelini, E., Simoni, P., Cevenini, L., Mezzanotte, L. and Roda, A. (2008). New trends in bioanalytical tools for the detection of genetically modified organisms: an update. Anal Bioanalytical Chemistry 392: 355–367.
Miraglia, M., Berdal, K.G., Brera, C., Corbisier, P., Holst-Jensen, A., Kok, E.J., Marvin, H.J.P., Schimmel, H., Rentsch, J., van Rie, J.P.P.F. and Zagon, J. (2004). Detection and traceability of genetically modified organisms in the food production chain. Food and Chemical Toxicology 42: 1157–1180.
Novak W.K. and Haslberger, A.G. (2000). Substantial equivalence of antinutrients and inherent plant toxins in genetically modified novel foods. Food and Chemical Toxicology 38: 473-483.
Paoletti, C., Flamm, E., Yan, W., Meek, S., Renckens, S., Fellous, M. and Kuiper, H. (2008). GMO risk assessment around the world: Some examples. Trends in Food Science & Technology 19: S70-S78.
Sayre, P. and Seidler, R. J. (2005). Application of GMOs in the U.S.: EPA research & regulatory considerations related to soil systems. Plant and Soil 275:77–91.
Smith, M.R. and König, A. (2010). Environmental risk assessment for food-related substances. Food Control 21: 1588–1600.
Sparrow, P.A.C. (2010). GM Risk Assessment. Molecular Biotechnology 44:267–275.
van Dijk, J.P., Leifert , C., Barros, E. and Kok, E.J. (2010). Gene expression profiling for food safety assessment: Examples in potato and maize. Regulatory Toxicology and Pharmacology 58: S21–S25.
Varzakas, T. H., Chryssochoidis, G. and Argyropoulos, D. (2007). Approaches in the risk assessment of genetically modified foods by the Hellenic Food Safety Authority. Food and Chemical Toxicology 45: 530–542.



